е®һйӘҢе®Өж–°й—?/h4>
йҷҲе…ҙгҖҒй»„еІ©и°ҠиҜҫйўҳз»„дёҺеҗҲдҪңиҖ…жҠҘйҒ“з©әй—ҙеҲҶиҫЁзҡ„еҚ•з»ҶиғһжөӢеәҸж–°ж–№жі•
еҚ•з»Ҷиғ?/span>иҪ¬еҪ•з»?/span>жөӢеәҸзӣ®еүҚе·ІжҲҗдёәз”ҹзү©еӯҰз ”з©¶дёӯзҡ„ж ёеҝғжҠҖжңҜжүӢж®?/span>пјҢе…¶иғҪеӨҹеё®еҠ©з ”究дәәе‘ҳиҺ·еҫ—з»„з»Үж ·е“ҒдёӯеҚ•з»Ҷиғһж°ҙе№ізҡ„еҹәеӣ иЎЁиҫҫдҝЎжҒҜгҖӮ然иҖҢпјҢдј з»ҹзҡ„еҚ•з»ҶиғһжөӢеәҸжөҒзЁӢйңҖиҰ?/span>е…?/span>е°Ҷз»„з»Үж¶ҲеҢ–дёәеҚ•з»ҶиғһжӮ¬ж¶ІпјҢиҝҷдёҖиҝҮзЁӢдјҡйҖ жҲҗз»Ҷиғһз©әй—ҙдҪҚзҪ®дҝЎжҒҜзҡ„дёўеӨұгҖ?/span>е·Іжңүзҡ„з©әй—?/span>еҲҶиҫЁеҚ•з»ҶиғһиҪ¬еҪ•з»„еҺҹдҪҚжөӢеәҸжҠҖжңҜеҫҖеҫҖеҸ—йҷҗдә?/span>дҪ?/span>з©әй—ҙеҲҶиҫЁзҺ?/span>гҖҒдҪҺйҖҡйҮҸе’Ңй«ҳиғҢжҷҜзӯүй—®йўҳгҖ?/span>
иҝ‘ж—ҘпјҢеҢ—дә¬еӨ§еӯҰеҢ–еӯҰдёҺеҲҶеӯҗе·ҘзЁӢеӯҰйҷўйҷҲе…ҙиҜҫйўҳз»„гҖҒй»„еІ©и°ҠиҜҫйўҳз»„дёҺеҢ—дә¬еӨ§еӯҰ第дёҖеҢ»йҷўжқЁиҺүиҜҫйўҳз»„еҗҲдҪңејҖеҸ‘дәҶдёҖз§Қе…Ёж–°зҡ„з©әй—ҙеҲҶиҫЁеҚ•з»ҶиғһжөӢеәҸжҠҖжң?/span>пјҲOpTAG-seqпјүгҖ?/span>иҜ?/span>ж–№жі•еҲ©з”Ёе…үжҝҖжҙ»зҡ„дәҡз”ІеҹәиӢҜйҶҢжҺўй’?/span>еҜ№зү№е®ҡдҪҚзҪ®зҡ„з»ҶиғһиҝӣиЎҢиҚ§е…үж Үи®°пј?/span>йҡҸеҗҺе°Ҷиў«ж Үи®°зҡ„з»ҶиғһиҝӣиЎҢеҲҶзҰ»е’ҢеҚ•з»Ҷиғ?/span>дәҢд»Је»әеә“жөӢеәҸпј?/span>еңЁиҺ·еҫ—й«ҳиҙЁйҮҸеҚ•з»ҶиғһжөӢеәҸж•°жҚ®зҡ„еҗҢж—¶дҝқз•ҷдә?/span>з»Ҷиғһзҡ?/span>з©әй—ҙдҪҚзҪ®дҝЎжҒҜгҖ?/span>
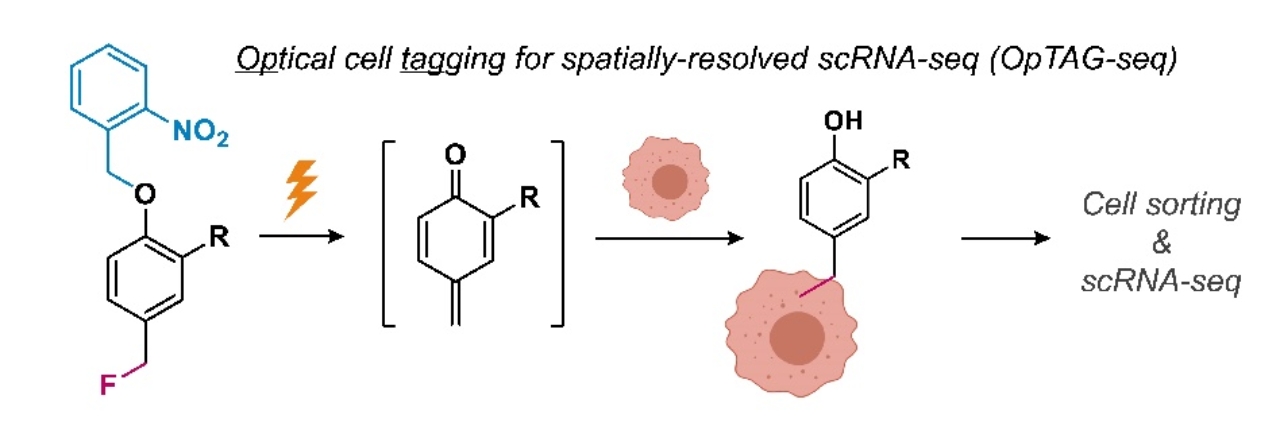
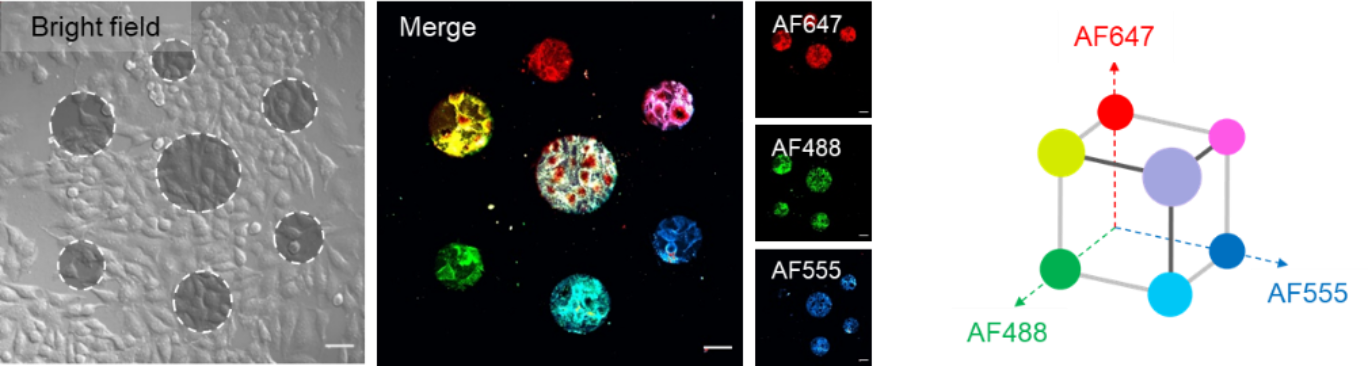
дёәдәҶе®һзҺ°й«ҳз©әй—ҙеҲҶиҫЁзҺҮзҡ?/span>з»Ҷиғһж Үи®°пј?/span>дҪңиҖ?/span>и®ҫ计并еҗҲжҲҗдәҶе…үжҝҖжҙ»жҺўй’ҲONPFпјҢ并еҹәдәҺе…¶ејҖеҸ‘дәҶе…үжҺ§з»Ҷиғһж Үи®°зӯ–з•ҘOpTAGгҖӮеңЁзҙ«еӨ–е…?/span>з…§е°„дёӢпјҢONPFиҪ¬еҢ–з”ҹжҲҗе…·жңүжһҒејәеҸҚеә”жҙ»жҖ§зҡ„дәҡз”ІеҹәиӢҜйҶҢдёӯй—ҙдҪ“гҖӮеңЁжҙ»з»ҶиғһиЎЁйқўпјҢиҜ?/span>дёӯй—ҙдҪ“иғҪеҝ«йҖҹең°дёҺз»ҶиғһиҶңдёҠзҡ„иӣӢзҷҪиҙЁзӯүдәІж ёиҜ•еүӮиҝӣиЎҢе…ұд»·иҝһжҺҘгҖ?/span>дҪңиҖ?/span>еңЁжҺўй’ҲдёҠеј•е…Ҙз”ҹзү©зҙ жҠҘе‘ҠеҹәеӣўпјҢе№?/span>еҲ©з”ЁиҚ§е…үдҝ®йҘ°зҡ?/span>й“ҫйңүдәІе’Ңзҙ еҜ№ж Үи®°иҝӣиЎҢиЎЁеҫҒгҖ?/span>дҪңиҖ?/span>иҜҒжҳҺиҝҷдёҖжҺўй’ҲиғҪеӨҹеңЁжҙ»з»ҶиғһиЎЁйқўе®һзҺ°еҫҲй«ҳз©әй—ҙеҲҶиҫЁзҺҮзҡ„ж Үи®°гҖӮйҖҡиҝҮеӨҡиҪ®ж Үи®°е’ҢйўңиүІз»„еҗҲпјҢOpTAGжңҖеӨҡеҸҜд»ҘеңЁдёҖд»Ҫж ·е“ҒдёӯеҗҢж—¶е®һзҺ°7дёӘдҪҚзҪ®зҡ„ж Үи®°пјҢдё”ж Үи®°зҡ„з©әй—ҙеҲҶиҫЁзҺҮеҸҜд»ҘиҫҫеҲ°еҚ•з»Ҷиғ?/span>ж°ҙе№ігҖ?/span>
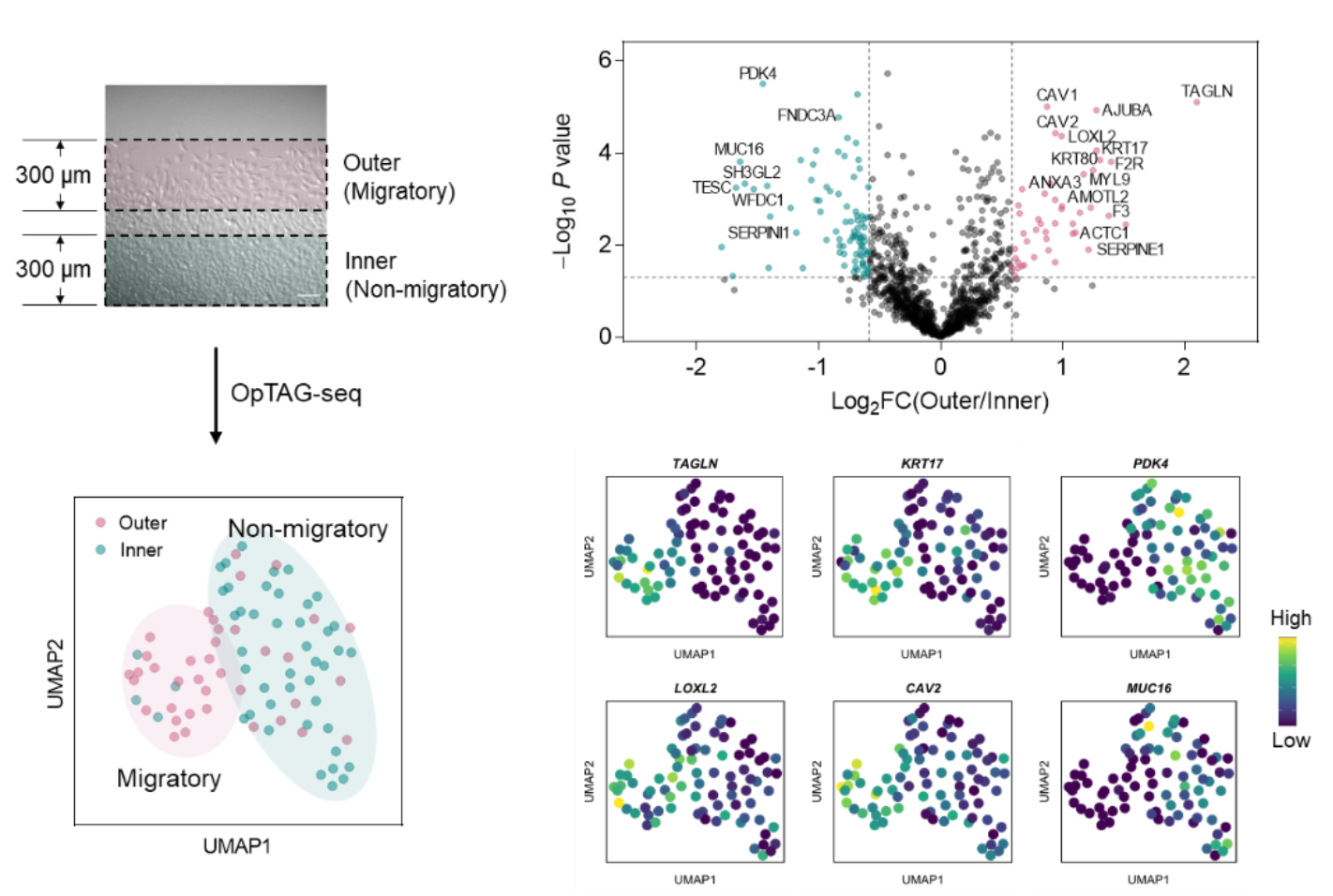
дҪңиҖ…йҡҸеҗҺе°ҶOpTAGж Үи®°пјҢжөҒејҸеҲҶйҖүдёҺеҚ•з»ҶиғһжөӢеәҸз»“еҗҲпјҢеҸ‘еұ•дәҶдёҖз§Қж–°зҡ„з©әй—?/span>еҲҶиҫЁеҚ•з»ҶиғһжөӢеәҸжҠҖжңҜOpTAG-seqгҖӮдҪңиҖ…еҲ©з”ЁOpTAG-seqжҺўз©¶дәҶзҷҢз—ҮиҝҒ移иҝҮзЁӢзҡ„еҹәеӣ иЎЁиҫҫи°ғжҺ§гҖӮеңЁдҪ“еӨ–жһ„е»әзҡ„зҷҢз»ҶиғһиҝҒ移模еһӢдёӯпјҢдҪңиҖ…еҲҶеҲ«еҜ№еӨ–йғЁе…·жңүй«ҳиҝҒ移жҙ»жҖ§е’ҢеҶ…йғЁзҡ„зҷҢз»ҶиғһиҝӣиЎҢOpTAG-seqеҲҶжһҗгҖӮз»“жһңжҳҫзӨәпјҢиҝҷдёӨйғЁеҲҶз»ҶиғһеңЁйҷҚз»ҙеҲҶжһҗдёӯе…·жңүжҳҺжҳҫзҡ„еҲҶз•ҢпјҢиҜҙжҳҺе…¶еҹәеӣ иЎЁиҫҫе…·жңүиҫғеӨ§е·®ејӮгҖӮдҪңиҖ…йүҙе®ҡеҲ°и®ёеӨҡеңЁй«ҳиҝҒ移жҙ»жҖ§з»ҶиғһдёӯдёҠи°ғжҲ–дёӢи°ғзҡ„еҹәеӣ гҖӮе…¶дёӯпјҢдёҠи°ғзҡ„иҝҷдәӣеҹәеӣ жҳҫи‘—ең°еҜҢйӣҶеңЁз»ҶиғһиҝҒ移е’Ңз»ҶиғһиҝҗеҠЁзӯүеҠҹиғҪжқЎзӣ®дёӯгҖӮдҪңиҖ…еҜ№е…¶дёӯдёӨдёӘйқ¶ж ҮиҝӣиЎҢдәҶе…Қз–«иҚ§е…үйӘҢиҜҒпјҢеҸ‘зҺ°KRT17жҳҫи‘—ең°еңЁеӨ–йғЁз»Ҷиғһй«ҳиЎЁиҫҫпјҢиҖҢMUC16еҲҷеңЁеҶ…йғЁз»Ҷиғһй«ҳиЎЁиҫҫпјҢдё?/span>жөӢеәҸз»“жһңй«ҳеәҰдёҖиҮҙгҖӮжӯӨеӨ–пјҢдҪңиҖ…иҝҳжҲҗеҠҹеҲ©з”ЁOpTAGеңЁе°Ҹйј иӮҫи„ҸеҲҮзүҮдёӯеҜ№дёҚеҗҢеҢәеҹҹиҝӣиЎҢй«ҳж•ҲиҚ§е…үж Үи®°пјҢиҜҒжҳҺиҝҷдёҖж–№жі•еңЁз»„з»ҮеұӮйқўд№ҹе…·жңүе№ҝйҳ”зҡ„еә”з”ЁеүҚжҷҜгҖӮд»ҘдёҠз»“жһңиҜҙжҳҺOpTAG-seqиғҪеӨҹжңүж•Ҳең°е®һзҺ°з©әй—?/span>еҲҶиҫЁеҚ•з»ҶиғһиҪ¬еҪ•з»„жөӢеәҸпјҢдёәз ”з©¶з»Ҷиғһе’Ңз»„з»Үдёӯеҹәеӣ иЎЁиҫҫзҡ„ж—¶з©әи°ғжҺ§жҸҗдҫӣдәҶжңүеҠӣзҡ„еҢ–еӯҰе·Ҙе…·гҖ?/span>
иҜ?/span>е·ҘдҪңиҝ‘ж—Ҙд»?/span>вҖңOptical Cell Tagging for Spatially Resolved Single-Cell RNA SequencingвҖ?/span>дёәйўҳеҸ‘иЎЁең?/span>Angewandte Chemie International EditionгҖ?/span>еҚҡеЈ«з”ҹе”җйә?/span>е’?/span>еҲҳз’җдё?/span>ж–Үз« е…?/span>еҗҢ第дёҖдҪңиҖ…гҖӮйғӯжҖЎе…°гҖҒеј ж—?/span>гҖ?/span>еј з»Қз„?/span>гҖ?/span>иҙҫзҮ•еҚҡеЈ«гҖ?/span>жқңйҖёйЈһеҚҡеЈ«гҖҒжҲҗжіўеҚҡеЈ«зӯүдё?/span>иҜ?/span>е·ҘдҪңеҒҡеҮәдәҶйҮҚиҰҒиҙЎзҢ®гҖ?/span>йҷҲе…ҙж•ҷжҺҲгҖ?/span>й»„еІ©и°?/span>ж•ҷжҺҲе’?/span>жқЁиҺүж•ҷжҺҲдё?/span>иҜҘи®әж–Үзҡ„е…ұеҗҢйҖҡи®ҜдҪңиҖ?/span>гҖ?/span>иҜҘе·ҘдҪңеҫ—еҲ°дәҶеӣҪ家иҮӘ然科еӯҰеҹәйҮ‘委гҖҒ科жҠҖйғ?/span>гҖ?/span>еҢ—дә¬еҲҶеӯҗ科еӯҰеӣҪе®¶з ”з©¶дёӯеҝғд»ҘеҸҠеҢ—еӨ§-жё…еҚҺз”ҹе‘Ҫ科еӯҰиҒ”еҗҲдёӯеҝғзҡ„иө„еҠ©гҖ?/span>
еҺҹж–Үй“ҫжҺҘпј?/span>//onlinelibrary.wiley.com/doi/10.1002/anie.202113929