е®һйӘҢе®Өж–°й—?/h4>
йҷҲй№ҸиҜҫйўҳз»„еҸ‘зҺ°з”ІйҶӣвҖңжҝҖжҙ»вҖқиӣӢзҷҪиҙЁзҡ„зӢ¬зү№еҢ–еӯҰдҝ®йҘ?/h1>
дҪңиҖ…пјҡ
жқҘжәҗпј?nbsp;
еҸ‘еёғж—Ҙжңҹ:2021-01-29
дҪңдёәдёҖз§?/span>з”ҹжҙ»дё?/span>зҡ„еёёи§?/span>иҮҙзҷҢзү©пјҢз”ІйҶӣдј?/span>еҜ№дәәдҪ?/span>дә§з”ҹеҫҲеӨ§зҡ?/span>еҚұе®ігҖӮдҪҶеҸҰдёҖж–№йқўпјҢз”ҹзү©дҪ“жң¬иә«д№?/span>дә§з”ҹдёҖе®?/span>йҮ?/span>зҡ„з”ІйҶӣгҖ?/span>иҝҷдәӣвҖңеҶ…жәҗвҖ?/span>з”ІйҶӣеҲҶеӯҗжҳ?/span>еӨҡжқЎз”ҹзҗҶд»Ји°ўйҖ”еҫ„зҡ?/span>еҺҹж–ҷжҲ–дә§зү?/span>пј?/span>дё?/span>з»Ҷиғһзҡ„еӯҳжҙ»дёҺз”ҹй•ҝеҜҶеҲҮзӣёе…ігҖ?/span>жңүз ”з©¶жҳҫзӨ?/span>пј?/span>дҪңдёәдёҖзўіеҢ–еҗҲзү©пјҢз”ІйҶӣиғҪеӨҹиў«зәіе…ҘдёҖзўіеҫӘзҺҜпјҲone-carbon-cycleпјүпјҢз”ЁдәҺDNAдё?/span>еҝ…йңҖж°Ёеҹәй…ёзҡ„еҗҲжҲҗпј?/span>Burgos-Barragan, G. et al. Nature, 2017, 548, 549вҖ?54пј?/span>гҖ?/span>иҷҪ然甲йҶӣзҡ?/span>иҝҷдәӣз”ҹзҗҶеҠҹиғҪйҖҗжёҗиў?/span>жҸӯзӨәпј?/span>дёҺз”ІйҶӣзӣёе…ізҡ„и®ёеӨҡз–‘й—®д»?/span>жңүеҫ…жҺўзҙўгҖӮдҫӢеҰӮпјҢз»ҶиғһжҳҜйҖҡиҝҮдҪ•з§ҚжңәеҲ¶жқ?/span>зү№ејӮиҜҶеҲ«е’Ңж„ҹзҹ?/span>еҶ…жәҗз”ІйҶӣзҡ?/span>жө“еәҰпј?/span>з”ІйҶӣеҜ№еә”зҡ„дҝЎеҸ?/span>жҳҜеҰӮдҪ?/span>еңЁз»ҶиғһеҶ…дј йҖ?/span>пј?/span>дә§з”ҹе“Қеә”пј?/span>е№?/span>йҒҝе…Қз”ІйҶӣйҖ жҲҗзҡ?/span>жҚҹдјӨпј?/span>жҲ?/span>们еҸҲиғҪеҗҰеҜ№з»ҶиғһеҶ…зҡ„з”ІйҶ?/span>еҠЁжҖҒеҲҶеё?/span>иҝӣиЎҢзІҫеҮҶжҺўжөӢпј?/span>д»?/span>жҸӯзӨәз”ІйҶӣзҡ„з”ҹзҗҶеҠҹиғҪе‘ўпј?/span>
й’ҲеҜ№дёҠиҝ°й—®йўҳпј?/span>еҢ—дә¬еӨ§еӯҰеҢ–еӯҰдёҺеҲҶеӯҗе·ҘзЁӢеӯҰйҷўгҖҒеҢ—еӨ?/span>-жё…еҚҺз”ҹе‘Ҫ科еӯҰиҒ”еҗҲдёӯеҝғйҷҲй№ҸиҜҫйўҳз»?/span>зқҖжүӢеҜ№дёҖдёӘзӢ¬зү№зҡ„з”ІйҶӣе“Қеә”зҡ?/span>иҪ¬еҪ•еӣ еӯҗHxlRиҝӣиЎҢдә?/span>ж·ұе…Ҙз ”з©¶пј?/span>йҰ–ж¬Ўд»Һз»“жһ„дёҺеҢ–еӯҰжңәзҗҶдё?/span>жҸӯзӨәдә?/span>з”ІйҶӣиҜұеҜјHxlRиӣӢзҷҪеҸ‘з”ҹеҲҶеӯҗеҶ…дәӨиҒ?/span>еҸҚеә”пј?/span>жүҖдә§з”ҹзҡ„вҖңдәҡз”ІеҹәжЎҘвҖ?/span>пј?/span>methylene bridgeпјүиҝҷдёҖзү№ж®ҠеҢ–еӯҰдҝ®йҘ°дҪ?/span>HxlRдә§з”ҹеҠҹиғҪиҺ·еҫ—жҖ?/span>пј?/span>gain-of-functionпј?/span>з”ҹзҗҶе“Қеә”гҖ?/span>еҹәдәҺиҝҷдёҖеҸ‘зҺ°пј?/span>他们ејҖеҸ‘дәҶйҰ–дёӘеҸ?/span>йҒ—дј зј–з Ғзҡ„з”ІйҶӣиҚ§е…үжҺўй’ҲпјҲFAsorпј?/span>пјҢжҲҗеҠҹеә”з”ЁдәҺжЈҖжөӢжҙ»з»Ҷиғһд»ҘеҸҠе°Ҹйј и„‘з»„з»ҮеҲҮзүҮдёӯз”ІйҶӣзҡ„еҠЁжҖҒеҸҳеҢ?/span>гҖ?/span>зӣёе…іжҲҗжһңдә?/span>2021е№?/span>1жң?/span>25ж—?/span>еңЁзәҝеҸ‘иЎЁең?/span>гҖҠиҮӘз„?/span>-йҖҡи®ҜгҖӢжқӮеҝ—пјҲNature Communicationsпј?/span>пј?/span>вҖңGenetically encoded formaldehyde sensors inspired by a protein intra-helical crosslinking reactionвҖ?/span> пј?/span>DOIпј?/span>10.1038/s41467-020-20754-4пј?/span>гҖ?/span>
з”ІйҶӣеҜ?/span>дә?/span>з”ҹзү©еӯҰе’ҢеҢ–еӯҰйўҶеҹҹзҡ„з ”з©¶иҖ…жқҘиҜҙ并дёҚйҷҢз”?/span>гҖ?/span>еҰӮжһңжҖқиҖғиҝҷж ·дёҖдёӘй—®йў?/span>пј?/span>з”ІйҶӣдёҺиӣӢзҷҪиҙЁдјҡеҸ‘з”ҹд»Җд№?/span>еҢ–еӯҰеҸҚеә”пј?/span>зӯ”жЎҲеҸҜиғҪжҳҜпјҢз”?/span>йҶ?/span>иғҪеӨҹдё?/span>иӣӢзҷҪиҙЁдёҠзҡ„дәІж ?/span>жҖ?/span>ж°Ёеҹәй…ёдҫ§й“ҫеҸ‘з”ҹеҠ жҲҗеҸҚеә?/span>пј?/span>з”ІйҶӣдҪңдёәиӣӢзҷҪиҙЁдәӨиҒ”иҜ•еүӮпјҢиғҪеӨҹеңЁиӣӢзҷҪиҙЁзҡ„дәІж ?/span>жҖ?/span>ж®Ӣеҹәпј?/span>еҰ?/span>иө–ж°Ёй…ёпјүд№Ӣй—ҙеҪўжҲҗдәӨиҒ”пј?/span>дҪҝиӣӢзҷҪиҙЁеҸҳжҖ§еӨұжҙ?/span>гҖ?/span>然иҖҢпјҢз”ІйҶӣдҪҝиӣӢзҷҪиҙЁеҸҳжҖ§зҡ„еҺҹеӣ дёҚиғҪдё?/span>з»Ҷиғһе“Қеә”з”ІйҶӣзҡ„жңәеҲ?/span>еҲ’зӯүеҸ?/span>гҖ?/span>йҰ–е…Ҳпј?/span>дҪҝиӣӢзҷҪиҙЁеҸҳжҖ§зҡ„з”ІйҶӣжө“еәҰиҝ?/span>й«ҳдәҺз»ҶиғһеҶ…жәҗз”ІйҶӣзҡ?/span>жө“еәҰиҢғеӣҙпј?/span>е…¶ж¬Ўпј?/span>з”ІйҶӣдҪҝиӣӢзҷҪиҙЁеҸҳжҖ§жҳҜдёҖз§Қйқһзү№ејӮжҖ§зҡ„гҖ?/span>жҚҹдјӨжҖ§зҡ„иҝҮзЁӢпј?/span>иҝҷеҫҲйҡҫдҪңдё?/span>з»ҶиғһзІҫзЎ®е“Қеә”е’Ңи°ғжҺ?/span>з”ҹзҗҶж°ҙе№із”ІйҶӣзҡ?/span>е·ҘдҪңжңәеҲ¶гҖ?/span>еӣ жӯӨпј?/span>з”ІйҶӣеңЁз»Ҷиғһдёӯжңүе“Әдә?/span>зү№ејӮжҖ§зҡ„е“Қеә”жЁЎејҸпј?/span>иҝҷдәӣе“Қеә”жҳҜйҖҡиҝҮд»Җд№Ҳж ·зҡ„еҲҶеӯҗжңәеҲ¶е®һзҺ°зҡ„пј?/span>д»ҚжҳҜдёҖдё?/span>жңӘзҹҘзҡ„й—®йўҳгҖ?/span>ең?/span>жһҜиҚүиҠҪеӯўжқҶиҸҢеҸ‘зҺ°зҡ?/span>HxlRиӣӢзҷҪжҳҜдёҖз§ҚиҪ¬еҪ•жҝҖжҙ»еӣ еӯ?/span>пј?/span>иғҪеӨҹеңЁз”ІйҶӣеҲәжҝҖдё?/span>жҝҖжҙ»дёӢжёёеҹәеӣ иҪ¬еҪ•пјҢиҝӣиЎҢеҠҹиғҪиҺ·еҫ—жҖ§пјҲgain-of-functionпјүзҡ„з”ҹзҗҶе“Қеә”пј?/span>Yurimoto, H. et al. Mol. Microbiol., 2005, 57, 511вҖ?19пј?/span>гҖ?/span>еҸ?/span>HxlRиҝҷдёҖзү№жҖ?/span>зҡ?/span>еҗёеј•пј?/span>з ”з©¶еӣўйҳҹйҖүжӢ©HxlRиӣӢзҷҪд»ҘжҺўз©?/span>е…?/span>вҖ?/span>зү№ејӮвҖ?/span>е“Қеә”з”ІйҶӣеҲҶеӯҗзҡ„жңәеҲ?/span>гҖ?/span>
йҰ–е…ҲпјҢдёәдәҶзЎ®и®?/span>HxlRиӣӢзҷҪзӣҙжҺҘдёҺз”ІйҶӣеҸ‘з”ҹдәҶеҢ–еӯҰеҸҚеә”пј?/span>з ”з©¶еӣўйҳҹз»“еҗҲиҙЁи°ұеҲҶжһҗдё?/span>Xе°„зәҝжҷ¶дҪ“еӯ?/span>з ”з©¶дә?/span>HxlRдёҺз”ІйҶ?/span>зҡ„зӣёдә’дҪңз”?/span>гҖ?/span>HxlRдёҺз”ІйҶ?/span>е…ұеӯөиӮ?/span>еҗ?/span>зҡ„иҙЁи°ұеҲҶжһҗжҳҫзӨ?/span>пј?/span>з”ІйҶӣиғҪеӨҹдҪ?/span>HxlRеҸ‘з”ҹ+12 Daзҡ„еҲҶеӯҗйҮҸеҒҸ移гҖӮиҝҷдёҖеҸҳеҢ–дё?/span>з”ІйҶӣиҜұеҜјзҡ„дәҡз”ІеҹәжЎ?/span>иҝ?/span>дёҖиҮҙпјҢиҜҙжҳҺHxlRеҫҲжңүеҸҜиғҪзӣҙжҺҘдёҺз”ІйҶӣеҸ‘з”?/span>дә?/span>еҸҚеә”гҖӮиҝӣдёҖжӯҘзҡ„дәҢзә§иҙЁи°ұиӮҪж®өйүҙе®ҡпјҢд»ҘеҸ?/span>HxlR-з”ІйҶӣе…ұжҷ¶з»“жһ„и§Јжһҗе…ұеҗҢдҪҗиҜҒдәҶиҝҷдёҖзӮ№гҖ?/span>дёӨиҖ…зҡ„з»“жһңеқҮжҳҫзӨәпјҢдёҺз”ІйҶӣеҸҚеә”д№ӢеҗҺпјҢдҪҚдәҺHxlRиӣӢзҷҪNз«?/span>第дёҖдё?/span>Оұиһәж—Ӣзҡ?/span>еҚҠиғұж°Ёй…ёпј?/span>Cys11пј?/span>дё?/span>иө–ж°Ёй…ёпјҲLys13пј?/span>ж®Ӣеҹәд№Ӣй—ҙеҪўжҲҗдә?/span>дҪҚзӮ№зү№ејӮзҡ?/span>вҖңдәҡз”ІеҹәжЎҘвҖ?/span>гҖ?/span>й’ҲеҜ№иҝҷдёҖеҸ‘зҺ°пј?/span>з ”з©¶еӣўйҳҹеҸҲйҖҡиҝҮдҪҚзӮ№зӘҒеҸҳжқҘзЎ®и®?/span>иҜ?/span>дәӨиҒ”еҸҚеә”дё?/span>HxlRиӣӢзҷҪеҠҹиғҪзҡ„иҒ”зі?/span>гҖ?/span>з»“жһңжҳҫзӨәпјҢж— и®?/span>зӘҒеҸҳе“?/span>дёҖдёӘдҪҚзӮ№пјҲC11AжҲ?/span>K13AпјүпјҢHxlRйғҪе°ҶеӨұеҺ»е“Қеә”з”ІйҶӣзҡ„иғҪеҠӣгҖ?/span>иҝҷиҜҙжҳ?/span>HxlRиӣӢзҷҪзҡ„зЎ®йҖҡиҝҮCys11е’?/span>Lys13зү№ејӮжҖ§иҜҶеҲ«з”ІйҶӣпјҢеҪўжҲҗдәҡз”ІеҹәжЎҘиҝҷдёҖзӢ¬зү№зҡ?/span>еҢ–еӯҰдҝ®йҘ°пј?/span>е®һзҺ°иҪ¬еҪ•еҠҹиғҪзҡ?/span>жҝҖжҙ?/span>гҖ?/span>
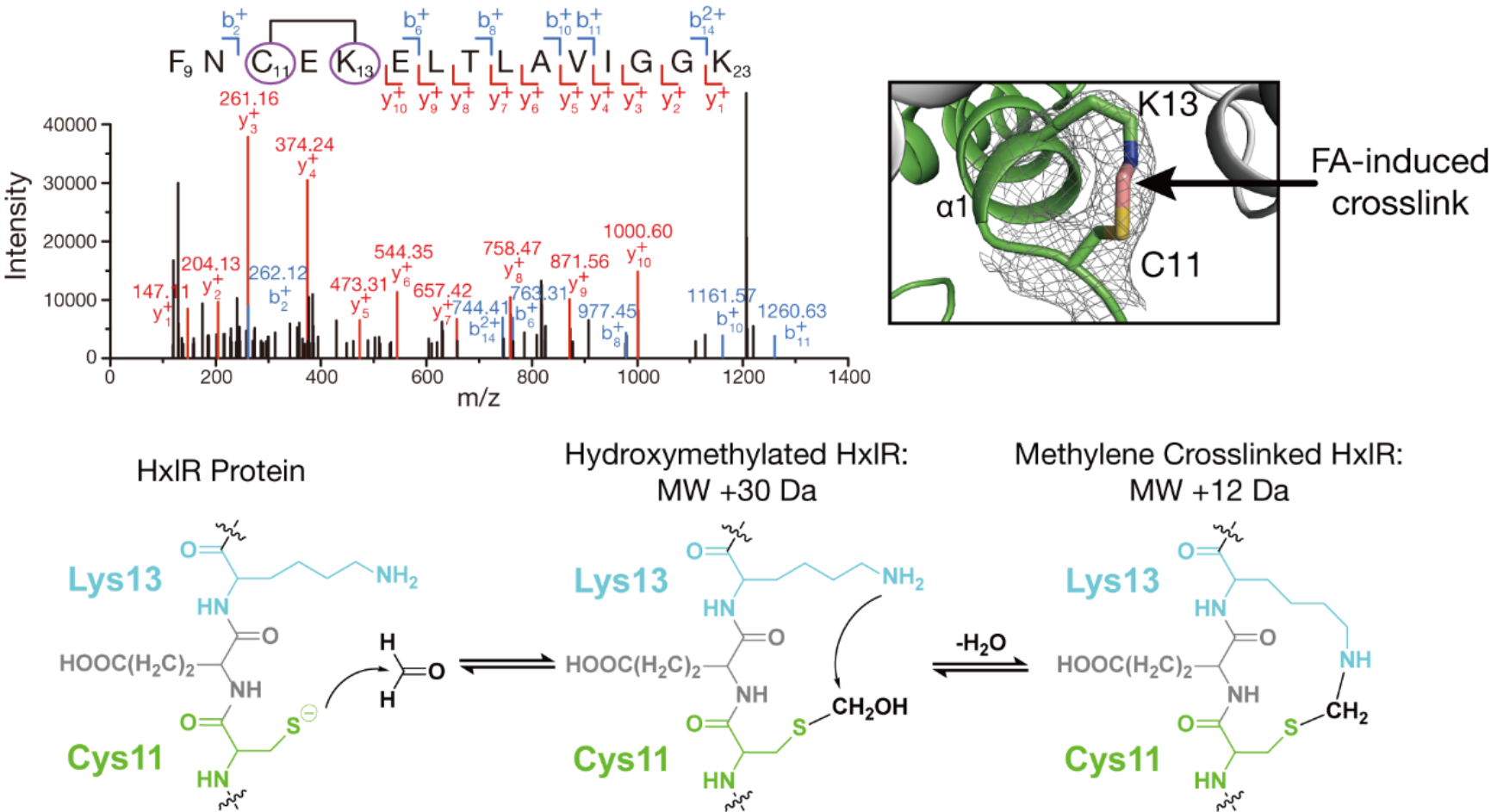
з”ІйҶӣдё?/span>HxlRиӣӢзҷҪдҪҚзӮ№зү№ејӮжҖ?/span>еҸҚеә”еҪўжҲҗеҲҶеӯҗеҶ?/span>вҖ?/span>дәҡз”ІеҹәжЎҘвҖ?/span>
йӮЈд№Ҳз”ІйҶӣиҜұеҜјзҡ„еҲҶеӯҗеҶ…дәӨиҒ”еҸҲжҳҜеҰӮдҪ•е®һзҺ°еҜ?/span>HxlRиӣӢзҷҪеҠҹиғҪзҡ?/span>жҝҖжҙ?/span>пј?/span>з ”з©¶еӣўйҳҹжҺҘдёӢжқҘд»”з»ҶеҲҶжһҗдәҶдёҚеҗҢеӨ„зҗҶжқЎд»¶дёҺзӘҒеҸҳдҪ“зҡ?/span>HxlRиӣӢзҷҪжҷ¶дҪ“з»“жһ„гҖ?/span>йҖҡиҝҮеҜ?/span>з”ІйҶӣеӨ„зҗҶеүҚеҗҺзҡ?/span>HxlRз»“жһ„еҜ№жҜ”пј?/span>他们еҸ‘зҺ°зңӢдјјз®ҖеҚ•зҡ„дәҡз”ІеҹәжЎҘеҚҙеј•иө·дәҶиӣӢзҷҪж•ҙдҪ“жһ„иұЎзҡ„жһҒеӨ§еҸҳеҢ–пјҒз”ІйҶӣиҜұеҜјзҡ?/span>Cys11-Lys13дәҡз”ІеҹәжЎҘиҝ«дҪҝеҺҹжң¬дҪҚдәҺеҗҢдёҖОұиһәж—ӢдёӨдҫ§зҡ?/span>дё?/span>дёӘж°Ёеҹәй…ёдҫ§й“ҫзӣёдә’йқ иҝ‘пј?/span>жүӯжӣІдә?/span>Оұиһәж—Ӣз»“жһ„пјҢ并вҖңзүөдёҖеҸ‘иҖҢеҠЁе…Ёиә«вҖқпјҢеёҰеҠЁHxlRиӣӢзҷҪNз«Ҝдё»й“ҫжңқеҗ‘зҝ»иҪ¬пјҲN-terminal flippingпјүпјҢдҪҝеҫ—иӣӢзҷҪж•ҙдҪ“жһ„иұЎеҸ‘з”ҹж”№еҸҳпј?/span>жһҒеӨ§ең?/span>еўһејәHxlRиӣӢзҷҪдё?/span>DNAзҡ„з»“еҗҲиғҪеҠ?/span>пј?/span>жҝҖжҙ?/span>дёӢжёёеҹәеӣ зҡ„иҪ¬еҪ?/span>гҖ?/span>иҮіжӯӨпј?/span>з ”з©¶еӣўйҳҹжҸӯзӨәдә?/span>HxlRзү№ејӮжҖ§е“Қеә”з”ІйҶӣ并еҸ‘з”ҹз»“жһ„дёҺеҠҹиғҪиҪ¬жҚўзҡ„еҲҶеӯҗжңәеҲ¶гҖ?/span>
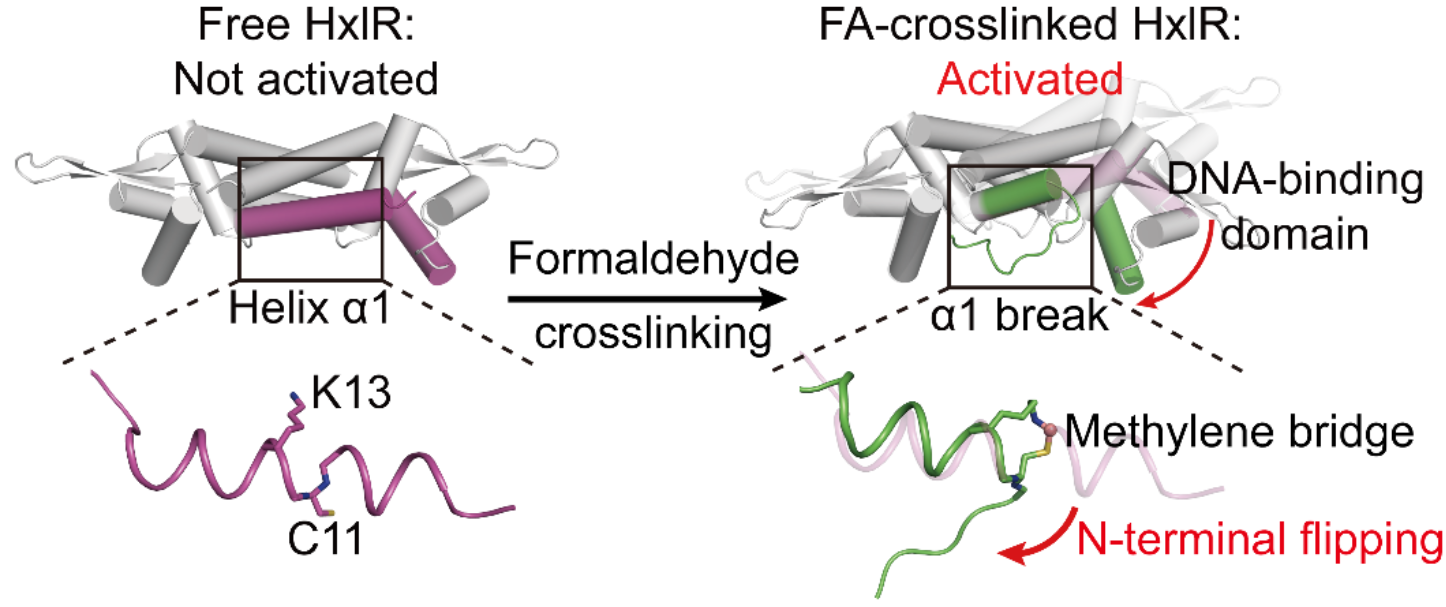
з”ІйҶӣйҖҡиҝҮдҪҚзӮ№зү№ејӮзҡ?/span>дәҡз”ІеҹәжЎҘиҝ?/span>жҝҖжҙ?/span>иҪ¬еҪ•еӣ еӯҗHxlR
иҝҷдёҖз”ІйҶӣе“Қеә”жңәеҲ¶зҡ„и§Јжһ?/span>иҝӣдёҖжӯ?/span>дё?/span>з ”з©¶еӣўйҳҹжҸҗдҫӣдә?/span>еҗҜзӨәпј?/span>HxlRзү№ејӮжҖ§е“Қеә”з”ІйҶӣзҡ„жһ„иұЎеҸҳеҢ–еҸҜд»Ҙз”ЁдәҺи®ҫи®Ўз”ІйҶӣжЈҖжө?/span>зҡ?/span>иҚ§е…үжҺўй’ҲгҖ?/span>зӣ®еүҚе·?/span>жҠҘйҒ“зҡ„з”ІйҶӣжҺўй’ҲеқҮдёәе°ҸеҲҶеӯҗжҺўй’ҲпјҢж—¶з©әеҲҶиҫЁзҺҮдё?/span>з»ҶиғһгҖ?/span>з»„з»Үзү№ејӮжҖ§еҸ—еҲ°йҷҗеҲ¶пјҢйҡҫд»ҘеҜ№з”ІйҶӣзҡ„з»ҶиғһеҶ…еҲҶеёғиҝӣиЎҢзІҫзЎ®жЈҖжөӢгҖ?/span>еҹәеӣ зј–з Ғзҡ„иҚ§е…үжҺўй’ҲпјҢеңЁж—¶з©әеҲҶиҫЁзҡ„жЈҖжөӢгҖҒеҠЁжҖҒжЈҖжө?/span>зӯ?/span>ж–№йқўйғҪжӣҙжң?/span>дјҳеҠҝпјҢдҪҶйүҙдәҺз”ІйҶӣе“Қеә”жңәеҲ¶з ”究зҡ„зјәд№ҸпјҢйҡҫд»Ҙи®ҫи®ЎеҹәдәҺиӣӢзҷҪиҙЁзҡ„жҺўй’ҲгҖ?/span>иҖ?/span>HxlRиӣӢзҷҪзӣёеә”з”ІйҶӣзҡ?/span>еҲҶеӯҗжңәеҲ¶зҡ„и§Јжһҗж— з–‘дёәиҝҷдёҖй—®йўҳжҸҗдҫӣдәҶи§ЈеҶіж–№жЎҲгҖ?/span>
еҹәдәҺеҜ?/span>HxlRиӣӢзҷҪзҡ„з»“жһ„еҲҶжһҗпјҢз ”з©¶еӣўйҳҹеҗ?/span>HxlRзү№е®ҡдҪҚзӮ№еөҢе…ҘдәҶеҜ№з»“жһ„еҸҳеҢ–ж•Ҹж„ҹзҡ„иҚ§е…үиӣӢзҷҪпјҢ并йҖҡиҝҮзӯӣйҖ?/span>е’ҢдјҳеҢ–пјҢжҲҗеҠҹејҖеҸ‘еҮәдёҖзі»еҲ—ж–°еһӢеҹәеӣ зј–з Ғзҡ„з”ІйҶӣиҚ§е…үжҺўй’ҲгҖӮ他们йҰ–е…ҲеңЁдҪ“еӨ–е®һйӘҢдёӯеҜ№жҺўй’ҲиҝӣиЎҢдәҶиЎЁеҫҒгҖӮд№ӢеҗҺпјҢз ”з©¶еӣўйҳҹеҲ©з”ЁиҜҘжҺўй’ҲпјҢжҲҗеҠҹиҝӣиЎҢдә?/span>з»ҶиғһеҶ…з”ІйҶӣжө“еәҰзҡ„еҠЁжҖҒжЈҖжө?/span>пјӣйҖҡиҝҮеӨҡиүІиҚ§е…үжҲҗеғҸпјҢеҜ№дёҚеҗҢдәҡз»Ҷиғһз©әй—?/span>дё?/span>з”ІйҶӣеҸҳеҢ–иҝӣиЎҢдәҶеҗҢжӯ?/span>жЈҖжө?/span>пј?/span>йҖҡиҝҮе№Іжү°з”ІйҶӣд»Ји°ўйҖҡи·ҜпјҢи®°еҪ•дәҶжҺўй’ҲеҜ?/span>иғһеҶ…з”ІйҶӣз”ҹзҗҶжө“еәҰеҸҳеҢ–зҡ„е“Қеә?/span>гҖ?/span>иҝӣдёҖжӯҘпјҢз ”з©¶еӣўйҳҹдёҺеҢ—дә¬еӨ§еӯҰжқҺжҜ“йҫҷиҜҫйўҳз»„еҗҲдҪңпјҢжЈҖжөӢдәҶиҜҘжҺўй’ҲеңЁе°Ҹйј и„‘з»„з»ҮеҲҮзү?/span>дё?/span>еҜ№з”ІйҶӣзҡ„еҠЁжҖҒе“Қеә?/span>пј?/span>йӘҢиҜҒдә?/span>иҜҘжҺўй’Ҳе…·жң?/span>еҠЁзү©з»„з»Үж°ҙе№ізҡ„еә”з”?/span>жҪңеҠӣгҖ?/span>
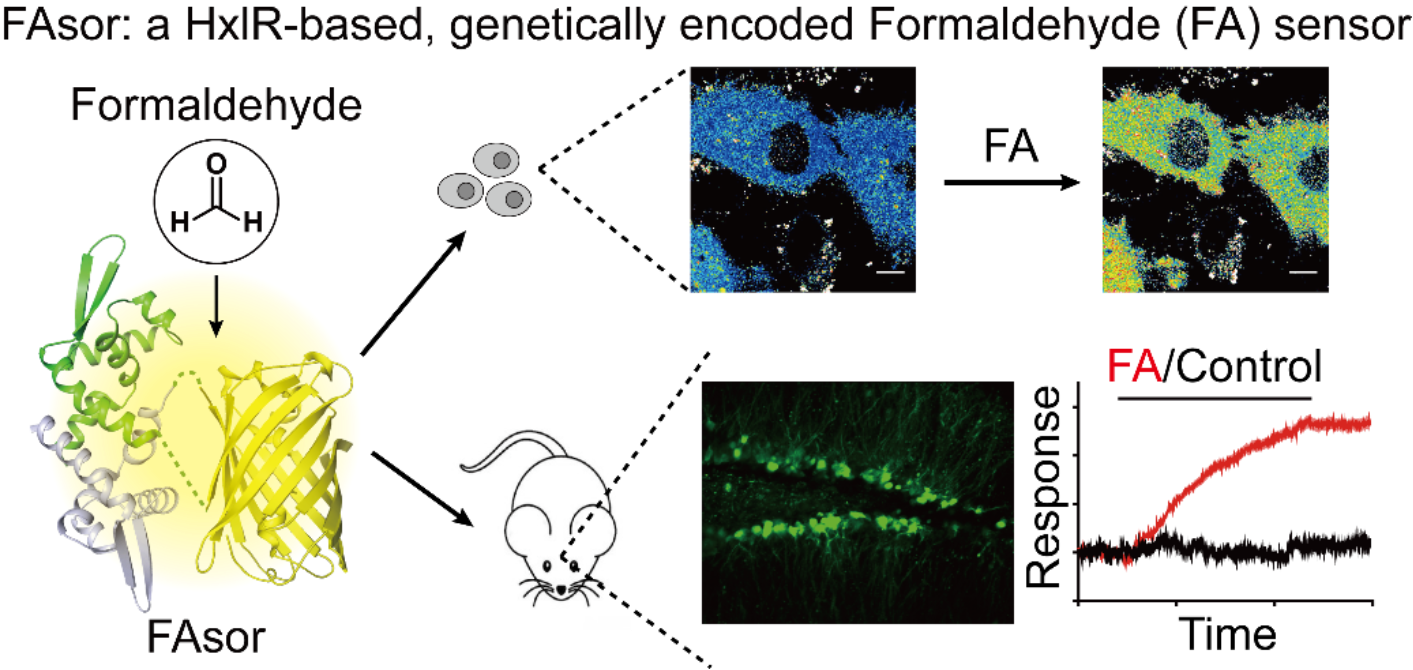
еҹәдәҺз”ІйҶӣе“Қеә”иҪ¬еҪ•еӣ еӯҗHxlRиӣӢзҷҪзҡ?/span>ж–°еһӢз”ІйҶӣжҺўй’Ҳ
з»јдёҠпјҢиҜҘе·ҘдҪңе®һзҺ°дә?/span>еҜ?/span>вҖ?/span>з”ІйҶӣе“Қеә”вҖ?/span>иӣӢзҷҪHxlRзҡ?/span>жңәеҲ¶и§Јжһҗпј?/span>еҸ‘зҺ°дәҶз”ІйҶ?/span>иҜұеҜјHxlRдә§з”ҹзӢ¬зү№еҢ–еӯҰдҝ®йҘ°пј?/span>并з”ұиҜ?/span>дәҡз”Іеҹ?/span>жЎ?/span>еј•иө·жһ„иұЎеҸҳеҢ–е’?/span>жҝҖжҙ»иҪ¬еҪ•и°ғжҺ§зҡ„еҲҶеӯҗжңәеҲ¶гҖ?/span>еҸ—жӯӨеҗҜеҸ‘пј?/span>з ”з©¶еӣўйҳҹиҝӣдёҖжӯ?/span>ејҖеҸ‘дәҶйҰ–дёӘйҒ—дј зј–з Ғзҡ?/span>з”ІйҶӣжҺўй’Ҳпј?/span>дёәз ”з©¶з»ҶиғһеҶ…жәҗз”ІйҶӣзҡ„и°ғжҺ§дёҺеҠҹиғ?/span>жҸҗдҫӣдәҶйҮҚиҰҒе·Ҙе…?/span>гҖ?/span>
йңҖиҰҒжҢҮеҮәзҡ„жҳҜпјҢжң¬з ”究еҸ‘зҺ°зҡ„вҖңеҲҶеӯҗеҶ…дәӨиҒ”вҖ?/span>иҝҷдёҖзӢ¬зү№зҡ?/span>еҢ–еӯҰдҝ®йҘ°пјҢеҸҜиғ?/span>дёҺиӣӢзҷҪй…°еҹәеҢ–гҖҒзғ·еҹәеҢ–зӯ?/span>зҝ»иҜ‘еҗҺдҝ®йҘ?/span>зұ»дјјпј?/span>иғҪеӨҹи°ғжҺ§иӣӢзҷҪиҙЁзҡ„жҙ»жҖ?/span>дёҺеҠҹиғ?/span>гҖ?/span>дҫӢеҰӮиҝ?/span>жң?/span>жңүз ”з©¶жҳҫзӨәпјҢзі–й…өи§ЈйҖҡи·Ҝзҡ„дёӯй—ҙдә§зү©дёҷй…®йҶӣпјҢеҸҜд»ҘеҜ№з»Ҷиғһж°§еҢ–еә”жҝҖйҖҡи·ҜиӣӢзҷҪKEAP1иҝӣиЎҢвҖңеҲҶеӯҗеҶ…дәӨиҒ”вҖ?/span>дҝ®йҘ°пјҢеңЁйӮ»иҝ‘зҡ?/span>зІҫж°Ёй…?/span>пј?/span>ArgпјүдёҺеҚҠиғұж°Ёй…ёпј?/span>Cysпјүд№Ӣй—?/span>дә§з”ҹдәӨиҒ”пјҢеҗҜеҠЁдёӢжёёеә”жҝҖе“Қеә”пј?/span>Bollong, M. et al. Nature, 2018, 562, 600вҖ?/span>604пј?/span>гҖ?/span>еҸҜд»Ҙйў„и§Ғ,вҖңеҲҶеӯҗеҶ…дәӨиҒ”вҖ?/span>дҝ®йҘ°зҡ?/span>з§Қзұ»гҖ?/span>жҖ§иҙЁдёҺеҠҹиғ?/span>пј?/span>еҖјеҫ—иҝӣдёҖжӯҘжҺўзҙўгҖ?/span>
йҷҲй№ҸиҜҫйўҳз»?/span>2012зә§еҚҡеЈ«жҜ•дёҡз”ҹзҘқиһҚеі°гҖҒеј еҠҹдёәе…ұеҗҢ第дёҖдҪңиҖ?/span>пј?/span>еҢ—дә¬еӨ§еӯҰз”ҹе‘Ҫ科еӯҰеӯҰйҷўгҖ?/span>з”ҹе‘Ҫ科еӯҰиҒ”еҗҲдёӯеҝғжқҺжҜ“йҫҷж•ҷжҺ?/span>еҸҠе…¶иҜҫйўҳз»?/span>2012зә§еҚҡеЈ«жҜ•дёҡз”ҹдә•ж·је®ҢжҲҗдә?/span>еҠЁзү©е®һйӘҢе…ій”®ж•°жҚ®гҖ?/span>иҜҘе·ҘдҪңеҫ—еҲ°дәҶеӣҪ家иҮӘ然科еӯҰеҹәйҮ‘委гҖҒ科жҠҖйғЁгҖҒеҢ—дә¬еҲҶеӯҗ科еӯҰеӣҪе®¶з ”з©¶дёӯеҝғд»ҘеҸҠеҢ—еӨ?/span>-жё…еҚҺз”ҹе‘Ҫ科еӯҰиҒ”еҗҲдёӯеҝғзҡ„иө„еҠ©гҖ?/span>
и®әж–Үй“ҫжҺҘпј?/span>//www.nature.com/articles/s41467-020-20754-4